Die Herausforderung dabei ist: Krebszellen besitzen die Fähigkeit, sich zu „tarnen“ und werden damit für das Immunsystem „unsichtbar“. Durch diese „Escape-Mechanismen“Escape-Mechanismen: Eigenschaften von Tumorzellen, die dazu führen, dass sie vom Immunsystem nicht als bösartige Zellen erkannt und daher wie gesundes Gewebe behalten werden. Dazu gehören auch zufällige Veränderungen in Tumorzellen, wodurch sich diese "tarnen" oder die Antwort des Immunsystems manipulieren bzw. schwächen können. Das bietet den Tumorzellen die Möglichkeit, sich vom Immunsystem ungestört unkontrolliert zu vermehren. bleiben die ImmunzellenImmunzellen: Zellen, die dem Immunsystem angehören und deren Funktion darin besteht, den Körper vor Krankheitserregern und anderen schädlichen Einflüssen zu schützen. Zu den Immunzellen zählen beispielsweise die B-Zellen, die T-Zellen, die Makrophagen („Fresszellen“) und die natürlichen Killerzellen. inaktiv und können die Krebszellen nicht bekämpfen.Liu Y, Cao X. Immunosuppresive cells in tumor immune escape and metastasis. J Mol Med (Berl). 2016;94(5):509–522. Seliger B. Strategies of tumor immune evasion. BioDrugs. 2005;19(6):347–354. Immunonkologische Therapien zielen darauf ab, diese Mechanismen zu durchbrechen.
Genauso wie Tumorzellen unterschiedliche Strategien verfolgen, um unentdeckt zu bleiben, gibt es bei der Immuntherapie verschiedene Behandlungsansätze. Dazu gehören beispielsweise die allogeneAllogen: Von einem anderen Menschen stammend (z. B. eine Fremdspende bei einer Stammzelltransplantation) StammzelltransplantationStammzelltransplantation: Bei einer Stammzelltransplantation werden den Betroffenen eigene oder fremde Stammzellen übertragen. Die Stammzellen sollen das blutbildende System und das Immunsystem neu aufbauen. oder die Gabe von spezifischen Antikörpern.Antikörper: Antikörper werden von Plasmazellen, einer Nachstufe der B-Zellen, produziert. Sie können Krankheitserreger oder Fremdstoffe anhand bestimmter Oberflächenstrukturen (Antigene) erkennen und daran binden. Dadurch neutralisieren sie diese Krankheitserreger oder Fremdstoffe und locken anschließend weitere Abwehrzellen an. Ein zentraler Bestandteil dieser modernen Verfahren sind die T-ZellenT-Zellen: T-Zellen gehören zu den weißen Blutkörperchen (Leukozyten) und sind ein Bestandteil des adaptiven („erworbenen“) Immunsystems. Sie können körperfremde Strukturen (Antigene) wie Krankheitserreger oder Krebszellen erkennen und bekämpfen. und deren Immunantwort.Koehl U, et al. Biotechnologische Innovationen im Bereich zellulärer Therapien. Forum 2020; 35(4):316–322. Houot R, et al. T-cell-based Immunotherapy: Adoptive Cell Transfer and Checkpoint Inhibition. Cancer Immunol Res. 2015;3(10):1115–1122. Zusammen mit den Natürliche KillerzellenNatürliche Killerzellen: Natürliche Killerzellen (NK-Zellen) gehören zu den weißen Blutkörperchen (Leukozyten) und sind ein Bestandteil des angeborenen Immunsystems. Sie können körperfremde Strukturen (Antigene) wie Krankheitserreger oder Krebszellen erkennen und entweder direkt oder durch die Produktion von Zytokinen bekämpfen. bilden T-Zellen effektive Waffen des Immunsystems und können die Krebszellen neutralisieren bzw. beseitigen.Bergmann C. Regulatorische T-Zellen und NK-Zellen bei Krebspatienten. HNO. 2014;62(6):406–414.
Wie genau wirkt die CAR-T-Zelltherapie?
- Bei der CAR-T-Zelltherapie werden T-Zellen der Patientinnen und Patienten entnommen, um sie außerhalb des Körpers gentechnisch zu verändern und mit chimären Antigenrezeptoren (chimeric antigen receptor, CAR)Chimäre Antigenrezeptoren: Chimäre Antigenrezeptoren (CAR) sind künstlich hergestellte Fusionsproteine, die sich auf der Oberfläche von im Labor veränderten T-Zellen bilden. Der CAR kombiniert Bausteine von unterschiedlichen Proteinen und nutzt dabei auch Teile eines Antikörpers. Somit können Strukturen (Antigene) auf der Oberfläche von Tumorzellen erkannt und die Immunantwort der körpereigenen, im Labor veränderten T-Zellen (nun CAR-T-Zellen genannt) gegen diese aktiviert werden. auszustatten.
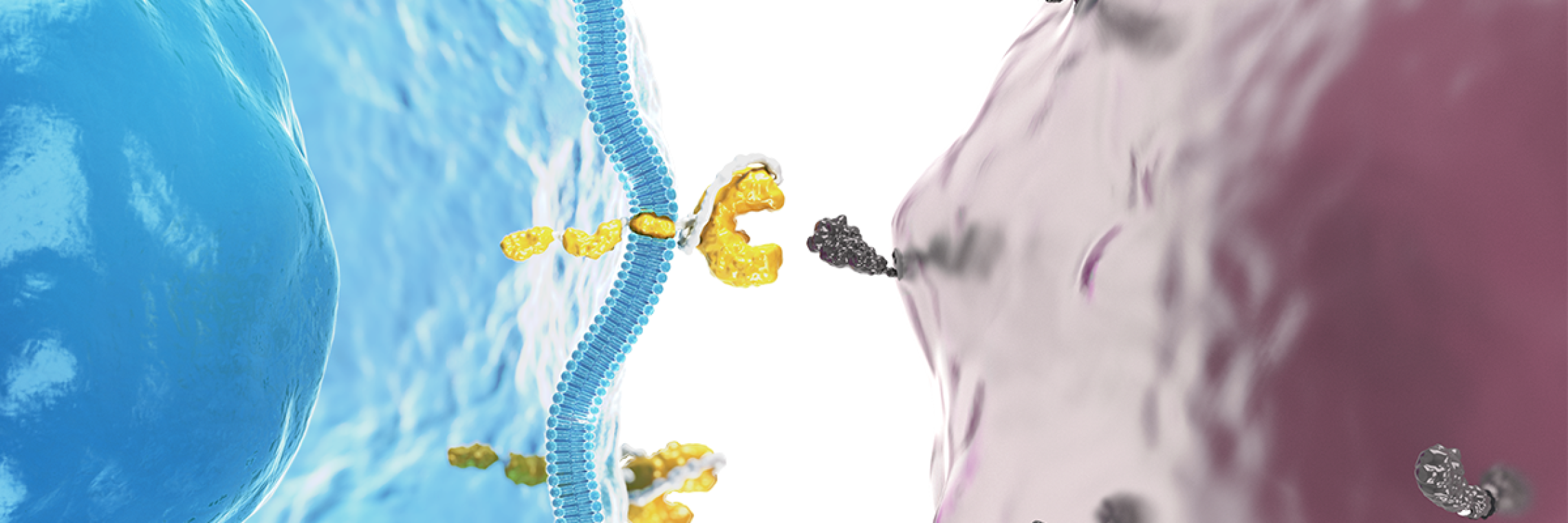
- Jedes CAR besteht aus mehreren Bausteinen, die das passende Zielmolekül auf der Oberfläche der Tumorzellen erkennen und daran binden können (Schlüssel-Schloss-Prinzip, siehe Abbildung).
- Einmal auf diese Weise aktiviert, leitet die CAR-T-Zelle durch ihre zytotoxischeZytotoxisch: Zellschädigende Wirkung z. B. von Zellen der Immunabwehr oder von Medikamenten (zellschädigende) Wirkung die Zerstörung der Krebszelle ein.
- Gleichzeitig vermehren sich die CAR-T-Zellen, sodass sie wie ein „lebendes Medikament“ im Körper verbleiben und bei wiederkehrender Erkrankung erneut aktiv eingreifen können.Maus MV, et al. Antibody-modified T cells: CARs take the front seat for hematologic malignancies. Blood. 2014;123(17):2625–2635. Schüssler-Lenz M, Müller-Berghaus J, Keller-Stanislawski B. Neuland: Wie man lebende Arzneimittel bewertet. Dtsch Aerztbl. 2018;115(39):A1702–A1706. Siegmund-Schultze N. Neue Strategien in der Onkologie: CAR-T-Zellen erreichen die klinische Praxis. Dtsch Aerztbl. 2019;116(49):A2304–A2307. Hudecek M. T-Zellen mit chimärem Antigenrezeptor (CAR) bei akuter B-Zell-Leukämie. Best Practice Onkologie. 2019;14(1–2):20–25. Hartmann J, et al. Clinical development of CAR T cells – challenges and opportunities in translating innovative treatment concepts. EMBO Mol Med 2017; 9(9):1183–1197.
Die CAR-T-Zelltherapie ist ein einmaliger Behandlungsprozess, der in sechs Schritten abläuft und aufgrund der komplexen Herstellung der patientenindividuellen Zellen häufig mehrere Wochen in Anspruch nimmt. Die Behandlung wird ausschließlich an spezialisierten Behandlungszentren durchgeführt und unterliegt sorgfältigen Kontrollen sowie hohen medizinischen Qualitätsstandards.Schüssler-Lenz M, Müller-Berghaus J, Keller-Stanislawski B. Neuland: Wie man lebende Arzneimittel bewertet. Dtsch Aerztbl. 2018;115(39):A1702–A1706. Siegmund-Schultze N. Neue Strategien in der Onkologie: CAR-T-Zellen erreichen die klinische Praxis. Dtsch Aerztbl. 2019;116(49):A2304–A2307. Hudecek M. T-Zellen mit chimärem Antigenrezeptor (CAR) bei akuter B-Zell-Leukämie. Best Practice Onkologie. 2019;14(1–2):20–25. Hartmann J, et al. Clinical development of CAR T cells – challenges and opportunities in translating innovative treatment concepts. EMBO Mol Med 2017; 9(9):1183–1197.